HYDROCARBON - ALKENE - LÝ THUYẾT
HYDROCARBON - ALKENE
I. KHÁI NIỆM
- Alkene là hydrocarbon mạch hở, chứa các liên kết đơn và có một liên kết đôi (C=C) trong phân tử.
- Alkene đơn giản nhất là ethylene (C₂H₄), có công thức cấu tạo thu gọn: CH₂=CH₂.
- Công thức chung: CₙH₂ₙ (n ≥ 2, n là số nguyên dương).
II. ETHYLENE
1. Cấu tạo phân tử và tính chất vật lí
- Công thức phân tử: C₂H₄.
- Công thức cấu tạo:
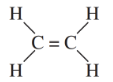
- Công thức cấu tạo thu gọn: CH₂=CH₂.
- Trong phân tử ethylene, giữa hai nguyên tử C có một liên kết đôi, trong đó có một liên kết kém bền ⇒ dễ bị phá vỡ ⇒ tạo nên tính chất đặc trưng của ethylene và các alkene khác.
- Ethylene là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
2. Tính chất hóa học
a) Phản ứng cháy
\(C_{2}H_{4} + 3O_{2} \xrightarrow{t^{\circ}} 2CO_{2} + 2H_{2}O\)
- Khi cháy trong không khí, ethylene tạo ra \(CO_{2}\) và \(H_{2}O\), phản ứng tỏa nhiều nhiệt.
- Nhận xét: \(n_{CO_{2}} = n_{H_{2}O}\).
b) Phản ứng cộng
- Thí nghiệm: Dẫn khí ethylene qua dung dịch nước brom màu da cam.
- Hiện tượng: Nước brom bị nhạt màu.
- Nhận xét: Ethylene đã cộng thêm vào liên kết đôi, làm mất màu dung dịch brom.
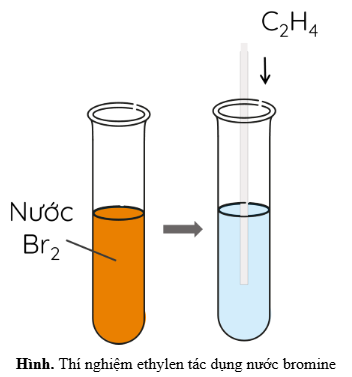
Phản ứng cộng của ethylene với nước bromine:
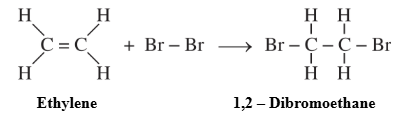
- Phân tử Br₂ cộng hợp vào liên kết đôi C=C trong phân tử C₂H₄.
- Liên kết kém bền trong liên kết đôi bị phá vỡ, tạo thành sản phẩm 1,2-đibromoethane.
Phương trình phản ứng:
\(CH_{2}=CH_{2} + Br_{2} \;\longrightarrow\; Br–CH_{2}–CH_{2}–Br\)
Viết gọn:
\(C_{2}H_{4} + Br_{2} \;\longrightarrow\; C_{2}H_{4}Br_{2}\)
⇒ Đây là phản ứng cộng.
- Tương tự ethylene, các alkene khác cũng làm mất màu dung dịch brom.
c) Phản ứng trùng hợp
- Trong điều kiện thích hợp, các phân tử ethylene cộng hợp liên tiếp với nhau.
- Liên kết đôi C=C trong phân tử ethylene bị phá vỡ, tạo thành mạch dài polyethylene (PE).
Phương trình hóa học:
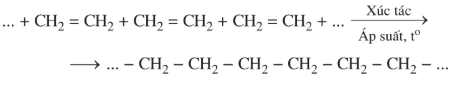
\(nCH_{2}=CH_{2} \xrightarrow{t^{\circ},\,xt,\,p} \, (-CH_{2}-CH_{2}-)_{n}\)
⇒ Phản ứng này gọi là phản ứng trùng hợp.
- Polyethylene (nhựa PE) là chất rắn, không tan trong nước, không độc.
- Ứng dụng: sản xuất túi nhựa, màng bọc, chai, bình chứa…
- Tuy nhiên, nhựa PE rất khó phân hủy sinh học, có thể tồn tại trong môi trường hàng trăm năm.
⇒ Cần hạn chế thải bỏ các sản phẩm làm từ nhựa PE ra ngoài môi trường.
3. Ứng dụng
- Ethylene được sử dụng trong nhiều lĩnh vực:
+ Tổng hợp ethylic alcohol (C₂H₅OH).
+ Sản xuất dung môi.
+ Tổng hợp acetic acid (CH₃COOH).
+ Sản xuất nhựa PE, PVC.
+ Kích thích quả mau chín.
- Trong công nghiệp, ethylic alcohol được sản xuất từ ethylene theo phản ứng:
\(CH_{2}=CH_{2} + H_{2}O \xrightarrow{acid,\,t^{\circ}} C_{2}H_{5}OH\)