Chủ đề 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
Chủ đề 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
I. PHẢN ỨNG MỘT CHIỀU & PHẢN ỨNG THUẬN NGHỊCH
| 1. Phản ứng một chiều | 2. Phản ứng thuận nghịch | |
|---|---|---|
| Khái niệm | Phản ứng một chiều là phản ứng xảy ra theo một chiều từ chất đầu sang sản phẩm trong cùng một điều kiện. \(aA + bB \longrightarrow cC + dD\) |
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện. \(aA + bB \rightleftharpoons cC + dD\) |
| Biểu diễn | Bằng một mũi tên: → | Bằng hai nửa mũi tên ngược chiều nhau: \( \rightleftharpoons \) |
| Ví dụ | \(CH_4 + 2O_2 \xrightarrow{t°} CO_2 + 2H_2O\) \(NaOH + HCl \longrightarrow NaCl + H_2O\) |
\(H_2(g) + I_2(g) \rightleftharpoons 2HI(g)\) |
II. CÂN BẰNG HÓA HỌC
1. Trạng thái cân bằng
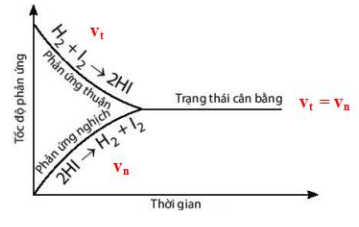
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch (\(v_t = v_n\)).
Đồ thị biểu diễn trạng thái cân bằng:
Ghi chú quan trọng:
Cân bằng hóa học là một cân bằng động ⇒ tại thời điểm cân bằng phản ứng vẫn diễn ra với tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Đặc điểm của trạng thái cân bằng:
Tốc độ phản ứng thuận = Tốc độ phản ứng nghịch
Nồng độ các chất không đổi theo thời gian
Phản ứng vẫn tiếp tục xảy ra (cân bằng động)
Có thể thiết lập từ hai phía: chất phản ứng hoặc sản phẩm
2. Hằng số cân bằng
a) Biểu thức của hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát: \(aA + bB \rightleftharpoons cC + dD\)
\(K_c = \dfrac{[C]^c.[D]^d}{[A]^a.[B]^b}\)
Một số lưu ý:
Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng.
\(K_c\) chỉ là hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
\(K_c\) chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức \(K_c\)
Ví dụ: \(C(s) + CO_2(g) \rightleftharpoons 2CO(g)\) \(K_c = \dfrac{[CO]^2}{[CO_2]}\)
b) Ý nghĩa của hằng số cân bằng
\(K_c\) càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại, K_c càng nhỏ thì phản ứng nghịch càng chiếm ưu thế hơn.
Phân tích:
\(K_c\) >> 1: Phản ứng thuận chiếm ưu thế, cân bằng chuyển dịch về phía sản phẩm
\(K_c\) << 1: Phản ứng nghịch chiếm ưu thế, cân bằng chuyển dịch về phía chất phản ứng
\(K_c\) ≈ 1: Phản ứng thuận và nghịch có mức độ tương đương
III. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
1. Ảnh hưởng của nhiệt độ (chất khí, chất lỏng)
"Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt (\(\Delta_r H°_{298} > 0\)), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại"
Cách nhớ:
| Điều kiện | Hiệu ứng nhiệt | Chuyển dịch cân bằng |
|---|---|---|
| \({\Delta _r}H_{298}^0 < 0\) | Phản ứng tỏa nhiệt | |
| \({\Delta _r}H_{298}^0 > 0\) | Phản ứng thu nhiệt | |
| Khi tăng t° | ⇒ phản ứng theo chiều thu nhiệt | \({\Delta _r}H_{298}^0 > 0\) |
| Khi giảm t° | ⇒ phản ứng theo chiều tỏa nhiệt | \({\Delta _r}H_{298}^0 < 0\) |
Lưu ý: Một phản ứng có ghi \({\Delta _r}H_{298}^0\) thì mặc định \({\Delta _r}H_{298}^0\) này là ứng với chiều thuận của phản ứng.
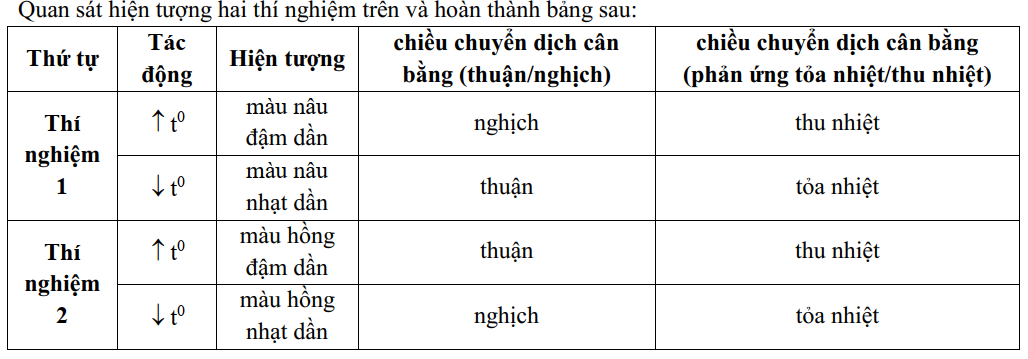
Thí nghiệm 1: Cho cân bằng: \(\mathop {2N{O_2}(g)}\limits_{mau\,\,nau} \rightleftharpoons \mathop {{N_2}{O_4}(g)}\limits_{Khong\,\,mau} {\text{ }}\,\,\,\,{\Delta _r}H_{298}^0 < 0\)
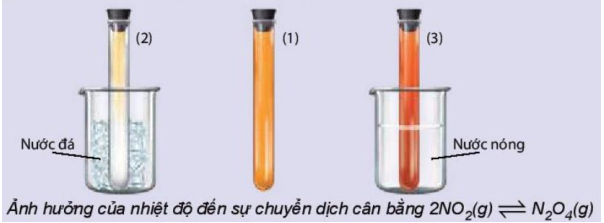
Ống (1): Nhiệt độ thường - màu cam
Ống (2): Làm lạnh (nước đá) - màu nhạt hơn
Ống (3): Đun nóng (nước nóng) - màu đậm hơn
Giải thích:
Khi giảm nhiệt độ → cân bằng chuyển theo chiều tỏa nhiệt → tạo thêm \(N_2O_4\) (không màu) → màu nhạt
Khi tăng nhiệt độ → cân bằng chuyển theo chiều thu nhiệt → tạo thêm [NO_2] (nâu) → màu đậm
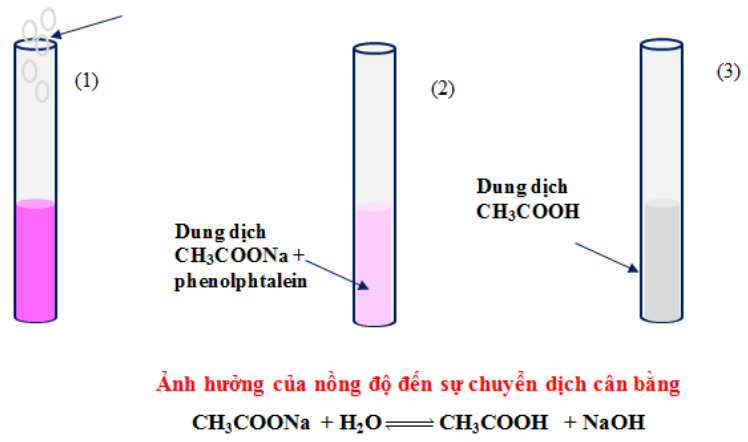
Thí nghiệm 2: \(C{H_3}COONa + {H_2}O \rightleftharpoons C{H_3}COOH + NaOH\,\,\,\,\,{\Delta _r}H_{298}^0 > 0\)

2. Ảnh hưởng của nồng độ (chất khí, chất lỏng)
"Khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm tác động của chất đó và ngược lại".
Cách nhớ:
\(aA + bB \rightleftharpoons cC + dD\)
Tác động lên chất phản ứng:
Tăng \({C_{pu}}{\text{ }}\left( {{C_A},{\text{ }}{C_B}} \right)\) ⇒ chiều thuận (làm giảm \({{C_A},{\text{ }}{C_B}}\))
Giảm \({C_{pu}}{\text{ }}\left( {{C_A},{\text{ }}{C_B}} \right)\) ⇒ chiều nghịch (làm tăng \({{C_A},{\text{ }}{C_B}}\))
Tác động lên sản phẩm:
Tăng \({C_{sp}}{\text{ }}\left( {{C_C},{\text{ }}{C_D}} \right)\) ⇒ chiều nghịch (làm giảm \({{C_C},{\text{ }}{C_D}}\))
Giảm \({C_{sp}}{\text{ }}\left( {{C_C},{\text{ }}{C_D}} \right)\) ⇒ chiều thuận (làm tăng \({{C_C},{\text{ }}{C_D}}\))
Quy tắc chung:
Tăng nồng độ một chất → cân bằng chuyển dịch theo chiều tiêu thụ chất đó
Giảm nồng độ một chất → cân bằng chuyển dịch theo chiều tạo thêm chất đó
Ví dụ: \(C{H_3}COONa + {H_2}O \rightleftharpoons C{H_3}COOH + NaOH\)
Phân tích:
Tăng [CH₃COONa] → cân bằng chuyển sang phải (tiêu thụ CH₃COONa)
Tăng [NaOH] → cân bằng chuyển sang trái (tiêu thụ NaOH)
Giảm [CH₃COOH] → cân bằng chuyển sang phải (tạo thêm CH₃COOH)