BÀI 18. TÍNH CHẤT CHUNG CỦA KIM LOẠI
BÀI 18. TÍNH CHẤT CHUNG CỦA KIM LOẠI
I. TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
Kim loại có tính chất vật lí chung: Tính dẻo; Tính dẫn điện, dẫn nhiệt; Ánh kim.
1. Tính dẻo
Nhờ tính dẻo, kim loại có thể kéo thành sợi, dát mỏng,…
Những kim loại có độ dẻo cao: Au, Ag, Al, Cu, Fe,…
Một số ứng dụng: giấy nhôm bọc thực phẩm, hộp đựng thức ăn bằng nhôm,…
2. Tính dẫn điện
Các kim loại khác nhau có khả năng dẫn điện khác nhau. Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al,...
Thực tế, người ta chủ yếu sử dụng Cu và Al làm dây dẫn điện vì chúng dẫn điện tốt và có giá thành rẻ hơn so với Ag, Au
3. Tính dẫn nhiệt
4. Ánh kim
Một số tính chất vật lí khác của kim loại:
Một số lưu ý:
Thuỷ ngân được sử dụng trong nhiệt kế y tế, tungsten được dùng làm dây tóc bóng đèn.
II. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
a) Tác dụng với oxygen
Hầu hết các kim loại như Ca, Mg, Al, Zn, Fe, Cu,... phản ứng với khí oxygen tạo thành oxide kim loại.
Một số kim loại như Au, Ag, Pt... không phản ứng với khí oxygen.
Ví dụ:
Khi đốt nóng dây sắt (đã được uốn thành hình lò xo) rồi đưa vào bình đựng khí oxygen, dây sắt cháy sáng tạo thành khói màu nâu đỏ theo phản ứng sau:
\(3Fe + 2{O_2}\xrightarrow{{{t^0}}}F{e_3}{O_4}\)
Rắc bột nhôm trên ngọn lửa đèn cồn, nhôm cháy sáng tạo thành chất rắn màu trắng:
\(4Al + 3{O_2}\xrightarrow{{{t^0}}}2A{l_2}{O_3}\)
Đốt cháy sợi dây magnesium ngoài không khí, magnesium phản ứng với oxygen theo phản ứng sau:
\(2Mg + {O_2}\xrightarrow{{{t^0}}}MgO\)
Nhiều kim loại tác dụng với lưu huỳnh (sulfur) tạo muối sulfide.
Nhiều kim loại (trừ Cu, Hg, Ag, Pt, Au, ...) phản ứng với dung dịch acid (HCl, H2SO4 loãng,..) tạo thành muối và giải phóng khí hydrogen.
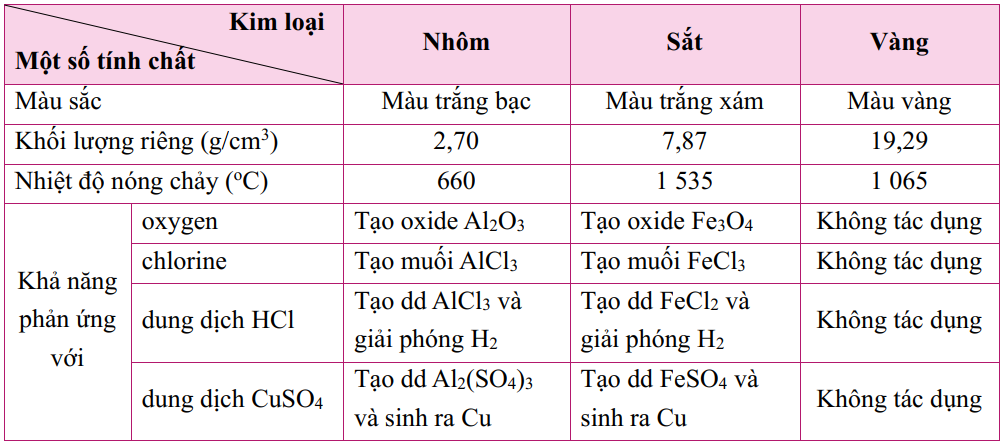
Nhôm bền trong môi trường không khí và nước do có lớp màng aluminium oxide (Al2O3) bền vững bảo vệ. Nhôm thường được sử dụng làm dây dẫn điện và là nguyên liệu để sản xuất vật dụng như khung cửa, vách ngăn, khung máy....
Sắt có nhiều ứng dụng trong đời sống và sản xuất, là thành phần chủ yếu trong gang và thép.
Vàng thường được sử dụng làm đồ trang sức, một số chi tiết của mạch điện tử....
